高考化学元素周期律选择题突破!
日期:2020-12-30 点击量:
1、推断出的元素是不确定的。
2、涉及到氢负离子——H—,H—与Cl—还原性的比较。
3、单质的熔沸点比较,要补充一些物构中晶体的知识。
4、陌生的物质的出现,如:CaF2与浓硫酸反应生成HF。
Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O。其实这一物质在2014年高考中就大规模出现过。
5、有小题大做的可能,如2016年与框图有机推断结合。
考点突破
考点一:化学键与物质类别

判断:
(1)Na2O和Na2O2所含化学键类型完全相同(×)
(2)NaOH和Na2O2所含化学键类型完全相同(×)
分析:
(1)中Na2O2含有共价键而Na2O中没有;
(2)Na2O2中含离子键和非极性共价键,NaOH中含离子键和极性共价键,共价键类型不同。
考点二:元素周期表
1.元素分布特点
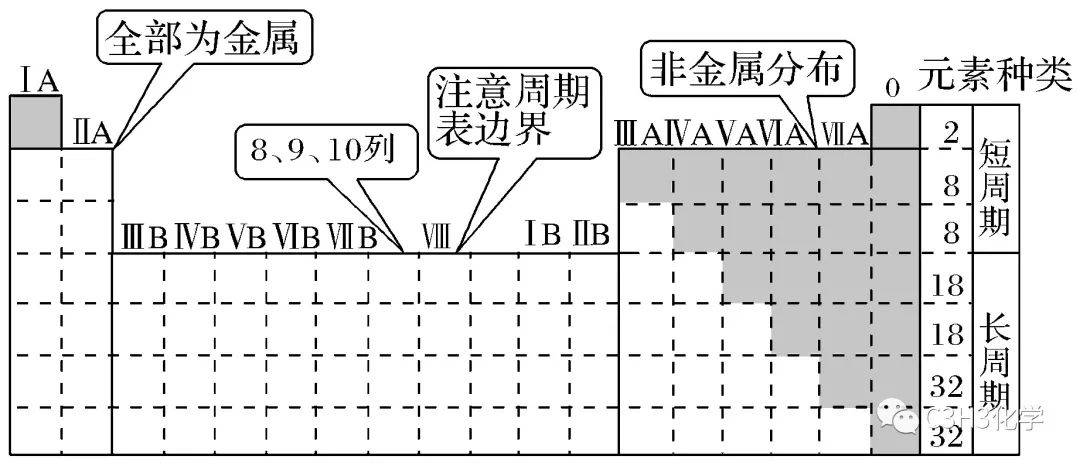
可以让学生画出上面的周期表,标出1—36号元素与主族元素。
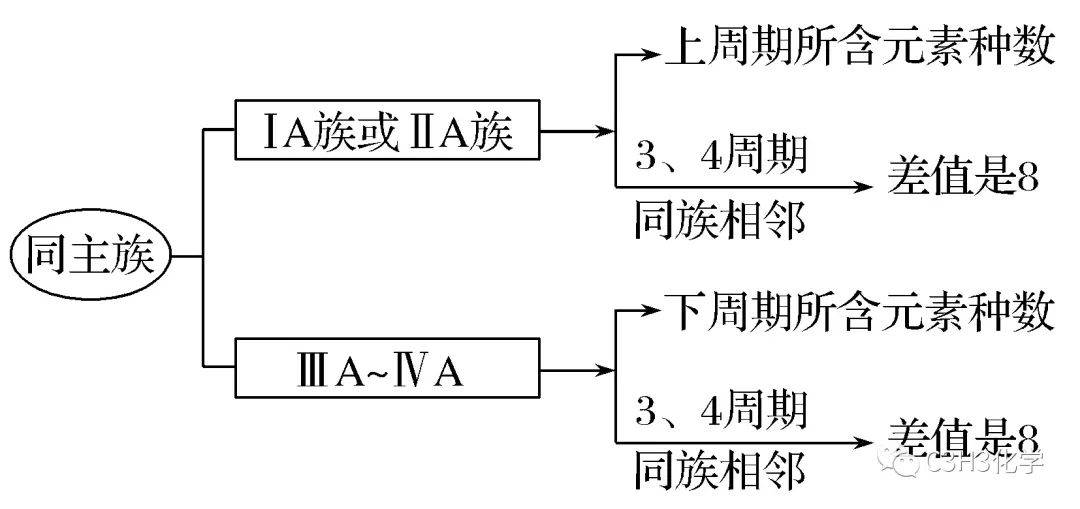
2.元素的位置关系和原子序数关系的应用
(1)同一周期中相邻元素的原子序数一般比左边元素原子序数大1,比右边元素的原子序数小1。
(2)同主族上下周期元素的原子序数关系的应用。
考点三:三大高频规律
|
规律 |
比较方法 |
|
金属性与非金属性 |
元素金属性、非金属性强弱的本质 原子越易失去电子,金属性就越强;原子越易得电子,非金属性就越强;即元素非金属性和金属性的强弱,取决于其原子得失电子的难易程度 |
|
判断元素金属性、非金属性强弱的事实依据: 1.置换反应:强的置换弱的,适合金属也适合非金属。 2.与水或酸反应越剧烈,或最高价氧化物对应水化物的碱性越强,则金属性越强。 3.与氢气反应越容易,生成的气态氢化物的稳定性越强,或最高价氧化物对应水化物的酸性越强,则非金属性越强 |
|
|
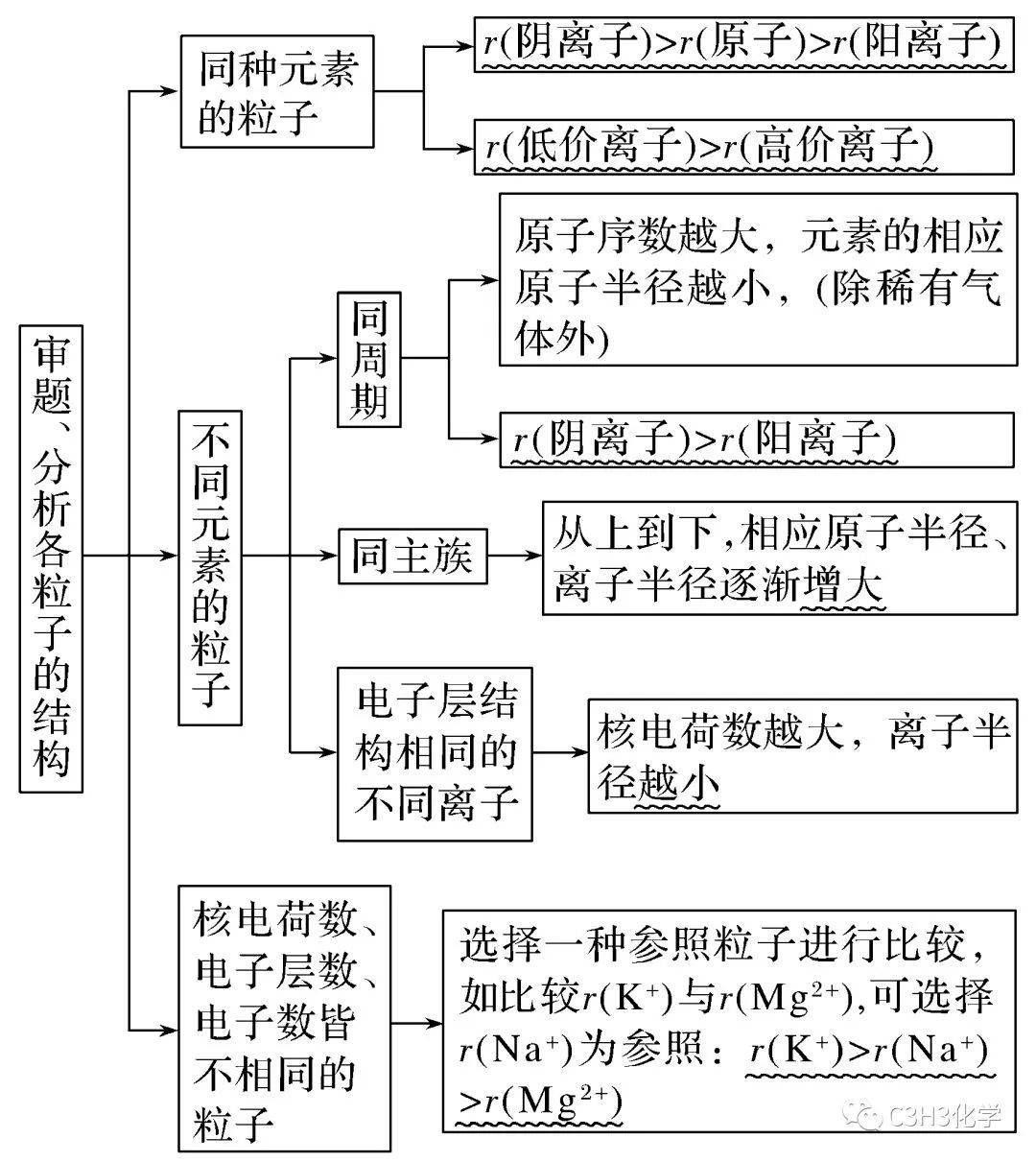
原子或 离子半 径比较 |
|
|
熔、沸点 比较 |
1.根据物质状态判断 即物质沸点高低按常温下的状态:固体>液体>气体。 如:NaCl>H2O>CO2 2.根据物质不同结构特点判断 一般情况下:原子晶体(金刚石、二氧化硅)>离子晶体(NaCl、K2S)>分子晶体(硫、干冰) |
|
3.分子晶体分子间作用力越大,物质的熔、沸点越高,反之越低 (1)组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔、沸点越高。如:CH4<SiH4<GeH4<SnH4 (2)因为氢键>范德华力,所以存在分子间氢键的物质沸点高于由只存在范德华力的物质。如:乙醇>氯乙烷;HF>HCl |
考点四:常见化合物转化
常见的转化关系总结
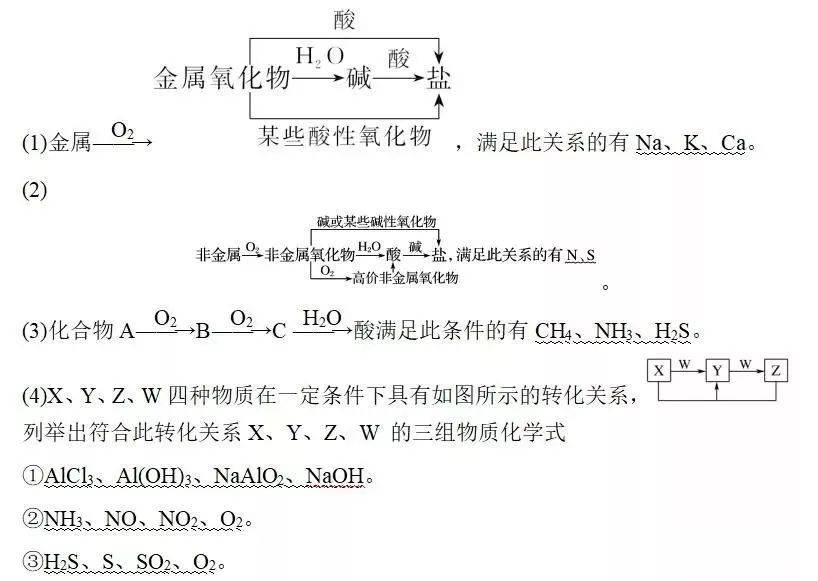
(5)已知A、B、D、E均为中学化学中的常见物质
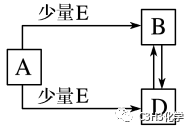
列举出符合此转化关系A、B、D、E 的三组物质的化学式
①Fe、Fe(NO3)3、Fe(NO3)2、HNO3。
②CuO、CO、CO2、C。
③NaOH、NaHCO3、Na2CO3、CO2。
(6)R、X、Y、Z是原子序数依次增大的短周期元素,a、b、c、d分别是这4种元素的单质。已知:Y是地壳中含量最高的金属元素。向甲的溶液中通入丙气体,产生白色沉淀,它们之间的转化关系如图所示。
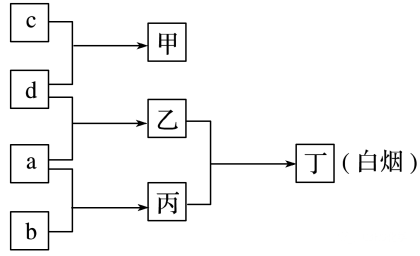
判断:R、 X、 Y、 Z分别为(元素符号)H、N、Al、Cl。
甲、乙、丙分别为(化学式)AlCl3、HCl、NH3。